Halaman ini menggambarkan teori asam dan basa Arrhenius, Bronsted-Lowry, dan Lewis, dan halaman ini juga menjelaskan hubungan antara ketiga teori asam dan basa tersebut. Halaman ini juga menjelaskan konsep pasangan konjugasi – asam dan basa konjugasinya, atau basa dan asam konjugasinya. Sumber : http://www.chem-is-try.org/materi_kimia/kimia_fisika1/kesetimbangan_asam_basa/teori_asam_dan_basa/
Teori asam dan basa Arrhenius
Teori
- Asam adalah zat yang menghasilkan ion hidrogen dalam larutan.
- Basa adalah zat yang menghasilkan ion hidroksida dalam larutan.
Penetralan terjadi karena ion hidrogen dan ion hidroksida bereaksi untuk menghasilkan air.
Pembatasan teori
Asam hidroklorida (asam klorida) dinetralkan oleh kedua larutan natrium hidroksida dan larutan amonia. Pada kedua kasus tersebut, kamu akan memperoleh larutan tak berwarna yang dapat kamu kristalisasi untuk mendapatkan garam berwarna putih – baik itu natrium klorida maupun amonium klorida.
Keduanya jelas merupakan reaksi yang sangat mirip. Persamaan lengkapnya adalah:
Pada kasus natrium hidroksida, ion hidrogen dari asam bereaksi dengan ion hidroksida dari natrium hidroksida – sejalan dengan teori Arrhenius.
Akan tetapi, pada kasus amonia, tidak muncul ion hidroksida sedikit pun!
anda bisa memahami hal ini dengan mengatakan bahwa amonia bereaksi dengan air yang melarutkan amonia tersebut untuk menghasilkan ion amonium dan ion hidroksida:
Reaksi ini merupakan reaksi reversibel, dan pada larutan amonia encer yang khas, sekitar 99% sisa amonia ada dalam bentuk molekul amonia. Meskipun demikian, pada reaksi tersebut terdapat ion hidroksida, dan kita dapat menyelipkan ion hidroksida ini ke dalam teori Arrhenius.
Akan tetapi, reaksi yang sama juga terjadi antara gas amonia dan gas hidrogen klorida.
Pada kasus ini, tidak terdapat ion hidrogen atau ion hidroksida dalam larutan – karena bukan merupakan suatu larutan. Teori Arrhenius tidak menghitung reaksi ini sebagai reaksi asam-basa, meskipun pada faktanya reaksi tersebut menghasilkan produk yang sama seperti ketika dua zat tersebut berada dalam larutan. Ini adalah sesuatu hal yang lucu!
Teori asam dan basa Bronsted-Lowry
Teori
- Asam adalah donor proton (ion hidrogen).
- Basa adalah akseptor proton (ion hidrogen).
Hubungan antara teori Bronsted-Lowry dan teori Arrhenius
Teori Bronsted-Lowry tidak berlawanan dengan teori Arrhenius – Teori Bronsted-Lowry merupakan perluasan teori Arrhenius.
Ion hidroksida tetap berlaku sebagai basa karena ion hidroksida menerima ion hidrogen dari asam dan membentuk air.
Asam menghasilkan ion hidrogen dalam larutan karena asam bereaksi dengan molekul air melalui pemberian sebuah proton pada molekul air.
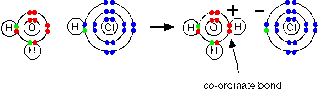
Ketika gas hidrogen klorida dilarutkan dalam air untuk menghasilkan asam hidroklorida, molekul hidrogen klorida memberikan sebuah proton (sebuah ion hidrogen) ke molekul air. Ikatan koordinasi (kovalen dativ) terbentuk antara satu pasangan mandiri pada oksigen dan hidrogen dari HCl. Menghasilkan ion hidroksonium, H3O+.
Ketika asam yang terdapat dalam larutan bereaksi dengan basa, yang berfungsi sebagai asam sebenarnya adalah ion hidroksonium. Sebagai contoh, proton ditransferkan dari ion hidroksonium ke ion hidroksida untuk mendapatkan air.
Tampilan elektron terluar, tetapi mengabaikan elektron pada bagian yang lebih dalam:
Adalah sesuatu hal yang penting untuk mengatakan bahwa meskipun anda berbicara tentang ion hidrogen dalam suatu larutan, H+(aq), sebenarnya anda sedang membicarakan ion hidroksonium.
Permasalahan hidrogen klorida / amonia
Hal ini bukanlah suatu masalah yang berlarut-larut dengan menggunakan teori Bronsted-Lowry. Apakah anda sedang membicarakan mengenai reaksi pada keadaan larutan ataupun pada keadaan gas, amonia adalah basa karena amonia menerima sebuah proton (sebuah ion hidrogen). Hidrogen menjadi tertarik ke pasangan mandiri pada nitrogen yang terdapat pada amonia melalui sebuah ikatan koordinasi.
Jika amonia berada dalam larutan, amonia menerima sebuah proton dari ion hidroksonium:
Jika reaksi terjadi pada keadaan gas, amonia menerima sebuah proton secara langsung dari hidrogen klorida:
Cara yang lain, amonia berlaku sebagai basa melalui penerimaan sebuah ion hidrogen dari asam.
Pasangan konjugasi
Ketika hidrogen klorida dilarutkan dalam air, hampir 100% hidrogen klorida bereaksi dengan air menghasilkan ion hidroksonium dan ion klorida. Hidrogen klorida adalah asam kuat, dan kita cenderung menuliskannya dalam reaksi satu arah:
Pada faktanya, reaksi antara HCl dan air adalah reversibel, tetapi hanya sampai pada tingkatan yang sangat kecil. Supaya menjadi bentuk yang lebih umum, asam dituliskan dengan HA, dan reaksi berlangsung reversibel.
Perhatikan reaksi ke arah depan:
- HA adalah asam karena HA mendonasikan sebuah proton (ion hidrogen) ke air.
- Air adalah basa karena air menerima sebuah proton dari HA.
Akan tetapi ada juga reaksi kebalikan antara ion hidroksonium dan ion A-:
- H3O+ adalah asam karena H3O+ mendonasikan sebuah proton (ion hidrogen) ke ion A-.
- Ion A- adalah basa karena A- menerima sebuah proton dari H3O+.
Reaksi reversibel mengandung dua asam dan dua basa. Kita dapat menganggapnya berpasangan, yang disebut pasangan konjugasi.
Ketika asam, HA, kehilangan sebuah proton asam tersebut membentuk sebuah basa A-. Ketika sebuah basa, A-, menerima kembali sebuah proton, basa tersebut kembali berubah bentuk menjadi asam, HA. Keduanya adalah pasangan konjugasi.
Anggota pasangan konjugasi berbeda antara satu dengan yang lain melalui kehadiran atau ketidakhadiran ion hidrogen yang dapat ditransferkan.
Jika anda berfikir mengenai HA sebagai asam, maka A- adalah sebagai basa konjugasinya.
Jika anda memperlakukan A- sebagai basa, maka HA adalah sebagai asam konjugasinya.
Air dan ion hidroksonium juga merupakan pasangan konjugasi. Memperlakukan air sebagai basa, ion hidroksonium adalah asam konjugasinya karena ion hidroksonium memiliki kelebihan ion hidrogen yang dapat diberikan lagi.
Memperlakukan ion hidroksonium sebagai asam, maka air adalah sebagai basa konjugasinya. Air dapat menerima kembali ion hidrogen untuk membentuk kembali ion hidroksonium.
Contoh yang kedua mengenai pasangan konjugasi
Berikut ini adalah reaksi antara amonia dan air yang telah kita lihat sebelumnya:
Hal pertama yang harus diperhatikan adalah forward reaction terlebih dahulu. Amonia adalah basa karena amonia menerima ion hidrogen dari air. Ion amonium adalah asam konjugasinya – ion amonium dapat melepaskan kembali ion hidrogen tersebut untuk membentuk kembali amonia.
Air berlaku sebagai asam, dan basa konjugasinya adalah ion hidroksida. Ion hidroksida dapat menerima ion hidrogen untuk membentuk air kembali.
Perhatikanlah hal ini pada tinjauan yang lain, ion amonium adalah asam, dan amonia adalah basa konjugasinya. Ion hidroksida adalah basa dan air adalah asam konjugasinya.
Zat amfoter
Anda mungkin memperhatikan (atau bahkan mungkin juga tidak memperhatikan!) bahwa salah satu dari dua contoh di atas, air berperilaku sebagai basa, tetapi di lain pihak air berperilaku sebagai asam.
Suatu zat yang dapat berperilaku baik sebagai asam atau sebagai basa digambarkan sebagai amfoter.
Teori asam dan basa Lewis
Teori ini memperluas pemahaman anda mengenai asam dan basa.
Teori
- Asam adalah akseptor pasangan elektron.
- Basa adalah donor pasangan elektron.
Hubungan antara teori Lewis dan teori Bronsted-Lowry
Basa Lewis
Hal yang paling mudah untuk melihat hubungan tersebut adalah dengan meninjau dengan tepat mengenai basa Bronsted-Lowry ketika basa Bronsted-Lowry menerima ion hidrogen. Tiga basa Bronsted-Lowry dapat kita lihat pada ion hidroksida, amonia dan air, dan ketianya bersifat khas.

Teori Bronsted-Lowry mengatakan bahwa ketiganya berperilaku sebagai basa karena ketiganya bergabung dengan ion hidrogen. Alasan ketiganya bergabung dengan ion hidrigen adalah karena ketiganya memiliki pasangan elektron mandiri – seperti yang dikatakan oleh Teori Lewis. Keduanya konsisten.
Jadi bagaimana Teori Lewis merupakan suatu tambahan pada konsep basa? Saat ini belum – hal ini akan terlihat ketika kita meninjaunya dalam sudut pandang yang berbeda.
Tetapi bagaimana dengan reaksi yang sama mengenai amonia dan air, sebagai contohnya? Pada teori Lewis, tiap reaksi yang menggunakan amonia dan air menggunakan pasangan elektron mandiri-nya untuk membentuk ikatan koordinasi yang akan terhitung selama keduanya berperilaku sebagai basa.
Berikut ini reaksi yang akan anda temukan pada halaman yang berhubungan dengan ikatan koordinasi. Amonia bereaksi dengan BF3 melalui penggunaan pasangan elektron mandiri yang dimilikinya untuk membentuk ikatan koordinasi dengan orbital kosong pada boron.
Sepanjang menyangkut amonia, amonia menjadi sama persis seperti ketika amonia bereaksi dengan sebuah ion hidrogen – amonia menggunakan pasangan elektron mandiri-nya untuk membentuk ikatan koordinasi. Jika anda memperlakukannya sebagai basa pada suatu kasus, hal ini akan berlaku juga pada kasus yang lain.
Asam Lewis
Asam Lewis adalah akseptor pasangan elektron. Pada contoh sebelumnya, BF3 berperilaku sebagai asam Lewis melalui penerimaan pasangan elektron mandiri milik nitrogen. Pada teori Bronsted-Lowry, BF3 tidak sedikitpun disinggung menganai keasamannya.
Inilah tambahan mengenai istilah asam dari pengertian yang sudah biasa digunakan.
Bagaimana dengan reaksi asam basa yang lebih pasti – seperti, sebagai contoh, reaksi antara amonia dan gas hidrogen klorida?

Pastinya adalah penerimaan pasangan elektron mandiri pada nitrogen. Buku teks sering kali menuliskan hal ini seperti jika amonia mendonasikan pasangan elektron mandiri yang dimilikinya pada ion hidrogen – proton sederhana dengan tidak adanya elektron disekelilingnya.
Ini adalah sesuatu hal yang menyesatkan! anda tidak selalu memperoleh ion hidrogen yang bebas pada sistem kimia. Ion hidogen sangat reaktif dan selalu tertarik pada yang lain. Tidak terdapat ion hidrogen yang tidak bergabung dalam HCl.
Tidak terdapat orbital kosong pada HCl yang dapat menerima pasangan elektron. Mengapa, kemudian, HCl adalah suatu asam Lewis?
Klor lebih elektronegatif dibandingkan dengan hidrogen, dan hal ini berarti bahwa hidrogen klorida akan menjadi molekul polar. Elektron pada ikatan hidrogen-klor akan tertarik ke sisi klor, menghasilkan hidrogen yang bersifat sedikit positif dan klor sedikit negatif.

Pasangan elektron mandiri pada nitrogen yang terdapat pada molekul amonia tertarik ke arah atom hidrogen yang sedikit positif pada HCl. Setelah pasangan elektron mandiri milik nitrogen mendekat pada atom hidrogen, elektron pada ikatan hidrogen-klor tetap akan menolak ke arah klor.
Akhirnya, ikatan koordinasi terbentuk antara nitrogen dan hidrogen, dan klor terputus keluar sebagai ion klorida.
Hal ini sangat baik ditunjukkan dengan notasi "panah melengkung" seperti yang sering digunakan dalam mekanisme reaksi organik.
DAFTAR PUSTAKA
Purba, Michael. 2006.
Kimia untuk SMA Kelas XI Semester 1. Jakarta: Erlangga
Harnanto, Ari dan Ruminten. 2009. Kimia 2Untuk SMA/MA Kelas XI. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional
http://www.chem-is-try.org/materi_kimia/kimia_fisika1/kesetimbangan_asam_basa/teori_asam_dan_basa/